Hensikt og omfang
- Forebygge infeksjoner hos pasienter som undersøkes med ultralyd.
- Hindre smittespredning til personell og forurensning av miljøet.
- Ivareta utstyrets funksjoner slik at dekontamineringsmetoden ikke skader utstyret.
- Prosedyren omfatter dekontaminering av ultralydprober og utstyr som brukes til kritiske, semikritiske og ikke-kritiske prosedyrer.
Fremgangsmåte
Bakgrunn
Utstyr til ultralydundersøkelse stiller spesielle krav til rengjøring, desinfeksjon og sterilisering, og ordinære metoder for dekontaminering av medisinsk utstyr kan ofte ikke benyttes. Kartlegging av praksis i andre land viser at ultralydutstyr ikke sjelden er forurenset, og at rutinene for dekontaminering ikke er tilfredsstillende (1-6). Det har også vært rapportert utbrudd som følge av kontaminert ultralydgel (se referanser under gel). I henhold til forskrift om medisinsk utstyr, er det produsent/leverandør av ultralydutstyret som skal dokumentere og anvise metoder for dekontaminering som gjør at utstyret er sikkert ved gjenbruk. Dette inkluderer både effekten av dekontaminering, og at metoden som benyttes er kompatibel med utstyret. Derfor er det viktig å følge ultralydprodusentens anbefalinger. Kontakt lokal smittevernavdeling for valg av dekontamineringsmetode.
Dekontaminering
Dekontaminering omfatter rengjøring, desinfeksjon og/eller sterilisering av medisinsk utstyr som skal gjenbrukes.
- Alle typer ultralydprober skal som minimum rengjøres og desinfiseres mellom hver pasient og steriliseres når det er nødvendig, avhengig av bruksområdet. Se vedlegg: Klassifisering av ultralydprober – flytskjema. Det bør benyttes maskinell dekontaminering av ultralydprober som brukes til semikritiske prosedyrer (kontakt med slimhinner), og kritisk utstyr (til sterile prosedyrer).
Bruk av ultralydgel
Det er mange rapporter om infeksjoner som følge av kontaminert ultralydgel. Bakterier kan vokse i gel, også gel som er tilsatt konserveringsmiddel. Kontaminering av prober kan oppstå som følge av forurenset gel (7-21).
Ultralydgel har blitt forbundet med utbrudd av nosokomiale infeksjoner (22-25)
- Både steril og usteril gel er tilgjengelig.
- Steril gel skal alltid brukes ved aseptiske prosedyrer.
- Steril gel anbefales ved alle undersøkelser på nyfødte (AIUM) - The American Institute of Ultrasound in Medicine).
- For prosedyrer som krever bruk av steril gel, må man forsikre seg om at bare uåpnede beholdere merket "steril" brukes. Er det ubrukt gel igjen i en steril engangsbeholder må den kastes og ikke benyttes til en annen pasient.
- Det anbefales å bruke endosebeholdere for kritiske og semikritiske prosedyrer.
- Ultralydgel i multidoseholdere skal merkes med åpningsdato.
- Multidosebeholdere må oppbevares som anbefalt av produsenten (17).
- Ubrukt gel kastes hvis beholder eller innholdet blir forurenset, eller beholder ikke er merket med åpningsdato.
- Gelbeholder desinfiseres utvendig ved begynnelsen og slutten av hver arbeidsdag.
- På grunn av risiko for vekst av bakterier og sopp i varme omgivelser, anbefales ikke oppvarming av gelbeholdere for flergangsbruk. Ved oppvarming bør det brukes en tørr varmekilde (ikke vannbad) (23).
- Før rengjøring og desinfeksjon/sterilisering av ultralydprober må all ultralydgel fjernes manuelt med en fuktet, lofri klut.
Holdbarhet etter anbrudd (brukstid) av steril gel
- Engangsbruk.
Holdbarhet etter anbrudd (brukstid) av usteril gel
- Ukonservert: kan oppbevares i 1 uke i kjøleskap.
- Konservert: kan oppbevares i 4 uker i romtemperatur.
Trekk til ultralydprober (26-34)
- Trekk skal alltid brukes når proben kommer i kontakt med slimhinner.
- Sterilt trekk og steril gel brukes ved aseptiske prosedyrer.
- Proben skal alltid rengjøres før desinfeksjon, selv etter bruk av trekk/kondom.
Ultralydprobens håndtak (35-37)
Håndtaket desinfiseres med samme desinfeksjonsmiddel som proben.
Dekontaminering av ultralydprober
Ultralydprober skal alltid først rengjøres og deretter desinfiseres. Maskinell desinfeksjon bør brukes for prober som kommer i kontakt med slimhinner.
Rengjøring (1-7)
- Ultralydprober skal alltid rengjøres grundig umiddelbart etter hver pasientundersøkelse, og før desinfeksjon, selv om det brukes trekk eller kondom.
- Hvis det brukes trekk, fjernes dette, og eventuell gel tørkes av med en myk klut.
- Bruk myk, fuktet klut med enzymatisk rengjøringsmiddel eller rengjøringsmiddel anbefalt av produsent.
- Rengjøringsmiddelet fjernes med ny klut fuktet med vann.
- Følg ultralydprodusentens anbefalte rengjøringsmetode nøye.
Desinfeksjon
Manuell desinfeksjon
- Følg brukerveiledningen for desinfeksjonsmidlet nøye og sørg for korrekt konsentrasjon og virketid.
- Etter fullført desinfeksjon med korrekt virketid, skylles proben med rent vann for å fjerne rester av kjemikalier. Deretter tørkes proben med en myk, lofri klut.
- Prober til semikritiske (kontakt med slimhinner) og kritiske (sterile) prosedyrer skal etter desinfeksjon skylles av med sterilt eller deionisert vann for å fjerne rester av kjemikalier. Deretter tørkes proben av med en steril, lofri kompress.
Maskinell desinfeksjon
- Prober som brukes i kontakt med slimhinner bør desinfiseres maskinelt. Alternative metoder er UVC eller hydrogenperoksidgass. Det forutsettes at den valgte metoden/maskinen er validert for aktuell probetype (38-39).
Sterilisering
- Prober som skal brukes til kritiske (sterile) prosedyrer skal steriliseres. Bruk anbefalt lavtemperatursteriliseringsmetode gitt av ultralydprodusenten.
Valg av desinfeksjonsmidler og virketider
Ved valg av desinfeksjonsmiddel bør det velges et middel med bredt antimikrobielt spekter, og med dokumentert effekt og virketid under urene forhold. Noen ganger vil dette avvike fra anbefalingene fra produsenten av desinfeksjonsmiddelet og virketider godkjent av Direktoratet for medisinske produkter.
Basert på dokumentasjon på antimikrobiell effekt av desinfeksjonsmidler, anbefales oksidative midler til desinfeksjon av medisinsk utstyr:
- Pereddiksyre
- Klordioksid
- Hydrogenperoksid
En forutsetning er at desinfeksjonsmiddelet er kompatibelt med de aktuelle probene.
Desinfeksjonssprit 70-75 % kan alternativt brukes til prober som bare benyttes på hel hud (ikke-kritisk utstyr) forutsatt at de er grundig rengjort først. Desinfeksjonssprit kan ikke brukes ved mistanke om norovirus eller Clostridioides difficile. Mange ultralydprober tåler ikke desinfeksjonssprit og bruk av desinfeksjonssprit må derfor være godkjent av produsent. Hvis produsent anbefaler annet godkjent desinfeksjonsmiddel i tillegg til desinfeksjonssprit, bør det benyttes.
Desinfeksjonsmidler som produsentene november 2024 har bekreftet kan brukes på deres respektive ultralydprober/transducere, se tabell: Ultralydprober – Anbefalte desinfeksjonsmidler - https://www.infeksjonskontroll.no/forebygging/8329.
Kvartære ammoniumforbindelser (QAC/quats) og aldehyder anbefales ikke til desinfeksjon av ultralydutstyr. Dette dels på grunn av utilstrekkelig effekt på relevante mikroorganismer, dels på grunn av HMS-problematikk eller andre ulemper.
Dekontaminering av ultralydapparater
Transdusere bør oppbevares i et rent og tørt miljø mellom bruk for å beskytte dem mot skade eller forurensning, og oppbevaringsmetoden bør være i samsvar med produsentens anbefalinger (Joint Commission). Prober kan oppbevares i et kommersielt tilgjengelig lukket, ventilert transduserskap eller henges vertikalt på et tildekket stativ. De bør oppbevares utenfor MDR-rommet (Medical Device Reprocessing) og pasientprosedyrerommet.
Rengjøring
Før desinfeksjon utføres grundig rengjøring. Bruk en myk klut fuktet med vann og enzymatisk rengjøringsmiddel eller rengjøringsmiddel anbefalt av produsenten.
Desinfeksjon
Sørg for å desinfisere alle overflater og overhold den angitte kontakttiden/virketiden for desinfeksjonsmiddelet. Pass på at hele styrekulens overflate blir desinfisert.
Til desinfeksjon av ultralydapparatet følges produsentens anbefalinger.
Oppbevaring av ultralydprober
Ultralydproben skal beskyttes mot tilfeldig kontaminasjon fra personer, miljøet og mot fysisk skade. Kravene til emballering og oppbevaring er avhengig av bruksområdet for proben. Prober som kommer i kontakt med slimhinner medfører en større smitterisiko, dette gjelder spesielt for pasienter med nedsatt immunforsvar. Sterile prober må håndteres på samme måte som annet sterilt utstyr. Produsentens bruksanvisning vil gi anbefalinger for riktig emballasje og oppbevaring.
Lagring av ultralydutstyr
Transdusere bør oppbevares i et rent og tørt miljø mellom bruk for å beskytte dem mot skade eller forurensning, og oppbevaringsmetoden bør være i samsvar med produsentens anbefalinger (Joint Commission). Prober kan oppbevares i et kommersielt tilgjengelig lukket, ventilert transduserskap eller henges vertikalt på et tildekket stativ. De bør oppbevares utenfor MDR-rommet (Medical Device Reprocessing) og pasientprosedyrerommet.
- Sørg for at probene er helt tørre før oppbevaring for å minimere mikrobiell vekst.
- Ikke oppbevar probene i plastposer eller i den originale forsendelsesesken, da disse kan inneholde kondens som kan føre til mikrobiell vekst.
- Etter HLD (High Level Disinfection) må ikke deler av proben som er desinfisert komme i kontakt med overflater, inkludert probekabelen eller oppbevaringsstativet, som ikke er desinfisert.
- Lag retningslinjer og prosedyrer for sporing av HLD eller sterilisering av prober.
- Oppbevar steriliserte prober i den forseglede emballasjen for å opprettholde steriliteten.
Hold kabler adskilt fra sonder: under høynivådesinfeksjon desinfiseres bare selve sonden. Sørg for at sondens kabel og elektriske kontakt ikke kommer i kontakt med sonden under håndtering og oppbevaring, da sonden kan bli forurenset på nytt.
Heng probene vertikalt: når de ikke er i bruk, heng probene vertikalt for å lette tørkingen, beskytte kabelen og holde proben og kabelen atskilt.
Bruk HEPA-filtre: et oppbevaringsskap med vifte og HEPA-filtrert luft gir positivt lufttrykk og forenkler tørking. Sørg for å bytte filtrene regelmessig hver 6. måned, basert på produsentens anbefaling. Datér filteret på tidspunktet for bytte.
Rengjøring av skapet bør utføres under hver sonderengjøringssyklus hver 5. dag. Rengjøringen består av å tørke av kabinettet med produkter anbefalt av produsenten.
Se også produsentens anbefalinger for lagring.
Definisjoner
Definisjon på kritisk, semikritisk og ikke-kritisk utstyr (vedlegg).
- Kritisk utstyr: Utstyr som kommer i kontakt med sterilt vev eller som gjennomstrømmes av sterile væsker. Dette er utstyr som skal være sterilt.
- Semikritisk utstyr: Utstyr som kommer i kontakt med slimhinner, men uten å penetrere disse. Dette utstyret skal være sterilt, eventuelt desinfisert med en validert desinfeksjonsprosess.
- Ikke-kritisk utstyr: Utstyr som kommer i kontakt med hel hud, men ikke slimhinner, eller som ikke kommer i direkte kontakt med pasient. Dette utstyret skal som minimum være desinfisert med en validert desinfeksjonsprosess.
Referanser
- Kac G, Podglajen I, Si-Mohamed A, Rodi A, Grataloup C, Meyer G. Evaluation of ultraviolet C for disinfection of endocavitary ultrasound transducers persistently contaminated despite probe covers. Infect Control Hosp Epidemiol. Feb. 2010, 31(2):165-70.
- Casalegno Js, Le Bail Carval K, Eibach D, Valdeyron ML, Lamblin G, et al. High Risk HPV Contamination of Endocavity Vaginal Ultrasound Probes: An Underestimated Route of Nosocomial Infection? PLoS ONE 2012;7(10): e48137. doi:10.1371/journal.pone.0048137
- Westerway SC, Basseal JM, Brockway A, Hyett JA, Carter DA. Potential infection control risks associated with ultrasound equipment: a bacterial perspective. Ultrasound Med Biol 2017; 43:421–426.
- Westerway SC, Basseal JM. The ultrasound unit and infection control: are we on the right track? Ultrasound 2017; 25:53–57.
- Westerway SC, Basseal JM. Advancing infection control in Australasian medical ultrasound practice. Austral J Ultrasound Med 2017; 20:26–29.
- Sartoretti T, Sartoretti E, Bucher C, et al. Bacterial contamination of ultrasound probes in different radiological institutions before and after specific hygiene training: do we have a general hygienical problem? Eur Radiol 2017; 27:4181–4187.
- Kruti J. Yagnik, Gautam Kalyatanda, Anthony P. Cannella, Lennox K. Archibald. Outbreak of Acinetobacter baumannii associated with extrinsic contamination of ultrasound gel in a tertiary centre burn unit. Infection Prevention in Practice, Volume 1, Issue 2, 2019.
- Gaillot O, Maruéjouls C, Abachin E, Lecuru F, Arlet G, Simonet M, et al. Nosocomial outbreak of Klebsiella pneumoniae producing SHV-5 extended-spectrum-ß-lactamase, originating from a contaminated ultrasonography coupling gel. J Clin Microbiol 1998;36(5):1357-1360.
- Health Canada, Health Products and Food Branch Inspectorate. Risk of serious infection from ultrasound and medical gels – notice to hospitals [Internet]. Ottawa: Health Canada; 2004. Available from: http://www.healthycanadians.gc.ca/recall-alert-rappel-avis/hc-sc/2004/14290a-eng.php?_ga=1.243051650.1024799928.1416943151
- Weist K, Wendt C, Petersen LR, Versmold H, Rüden H. (2000). An outbreak of pyodermas among neonates caused by ultrasound gel contaminated with methicillin-susceptible Staphylococcus aureus. Infect Control Hosp Epidemiol 2000;21(12):761-764.
- Hutchinson J, Runge W, Mulvey M, et al. Burkholderia cepacia infections associated with intrinsically contaminated ultrasound gel: the role of microbial degradation of parabens. Infect Control Hosp Epidemiol 2004;25:291-296.
- Jacobson M, Wray R , Kovach D, Henry D, Speert D, Matlow A. Sustained Endemicity of Burkholderia cepacia Complex in a Pediatric Institution, Associated With Contaminated Ultrasound Gel. Infect Control Hosp Epidemiol 2006;27:362- 366.
- Olshtain-Pops K, Block C, Temper V, Hidalgo-Grass C, Gross I, Moses AE, et al. An outbreak
Achromobacter xylosoxidans associated with ultrasound gel used during transrectal ultrasound guided prostate biopsy. J Urol 2011;185(1):144-7. - Chittick P, Russo V, Sims M, Oleszkowicz S, Sawarynski K, Powell K, et al. Outbreak of Pseudomonas Aeruginosa respiratory tract infections in cardiovascular surgery associated with contaminated ultrasound gel used for transesophageal echocardiography —Michigan, December 2011–January 2012. MMWR Morb Mortal Wkly Rep. 61:262–264.
- Hell M, Abel C, Albrecht A, Wojna A, Chmelizek G, Kern JM, et al. Burkholderia cepacia - outbreak in obstetric patients due to intrinsic contamination of non-sterile ultrasound gel. BMC Proc 2011;5(Suppl 6):O75.
- Oleszkowicz SC, Chittick P, Russo V, Keller P, Sims M, Band J. Infections Associated with Use of Ultrasound Transmission Gel: Proposed Guidelines to Minimize Risk. Infect Control Hosp Epidemiol 2012;33(12):1235-1237.
- Spratt HG, Levine D, Tillman L. Physical therapy clinic therapeutic ultrasound equipment as a source for bacterial contamination. Physiother Theory Pract 2014;30(7): 507–511.
- Shaban RZ, Maloney S, Gerrard J, Collignon P, Macbeth D, Cruickshank M, et al. Outbreak of health care-associated Burkholderia cenocepacia bacteremia and infection attributed to contaminated sterile gel used for central line insertion under ultrasound guidance and other procedures. Am J Infect Control 2017;45:954-8.
- Abdelfattah R, Aljumaah S, Alqahtani A, et al. Outbreak of Burkholderia cepacia bacteraemia in a tertiary care centre due to contaminated ultrasound probe gel. J Hosp Infect 2018;98:298-94.
- Solaimalai D, Devanga Ragupathi NK, Ranjini K, et al. Ultrasound gel as a source of hospital outbreaks: Indian experience and literature review. Indian J Med Microbiol. 2019; 37:263-267.
- Ricci S, Pinette MG, Wax JR, Craig W, Forrest L, Dragoni C. The effect of temperature on bacterial growth in the presence of nonsterile ultrasound coupling gel. Am J Obstet Gynecol 2020;222(2):188.
- Hutchinson J, Runge W, Mulvey M, et al. Burkholderia cepacia infections associated with intrinsically contaminated ultrasound gel: the role of microbial degradation of parabens. Infect Control Hosp Epidemiol 2004;25:291-296.
- Westerway SC, Basseal JM, Brockway A, Hyett JA, Carter DA. Potential infection control risks associated with ultrasound equipment: a bacterial perspective. Ultrasound Med Biol 2017; 43:421–426.
- Ricci S, Pinette MG, Wax JR, Craig W, Forrest L, Dragoni C. The effect of temperature on bacterial growth in the presence of nonsterile ultrasound coupling gel. Am J Obstet Gynecol 2020;222(2):188.
- Australasian Society for Ultrasound in Medicine and the Australasian College for Infection Prevention and Control (AJUM). Guidelines for Reprocessing Ultrasound Transducers. AJUM Feb. 2017, 20 (1):30-40 - https://onlinelibrary.wiley.com/doi/pdf/10.1002/ajum.12042
- Pichon M, Lebail-Carval K, Billaud G, Lina B, Gaucherand P, Mekki Y. Decontamination of Intravaginal Probes Infected by Human Papillomavirus (HPV) Using UV-C Decontamination System. J Clin Med. 2019 Oct 24;8(11):1776.
- Hignett M, Claman P. High rates of perforation are found in endovaginal ultrasound probe covers before and after oocyte retrieval for in vitro fertilization-embryo transfer. J Assist Reprod Genet. 1995;12(9):606-609.
- Rooks VJ, Yancey MK, Elg SA, Brueske L. Comparison of probe sheaths for endovaginal sonography. Obstet Gynecol. 1996;87(1):27-29.
- Storment JM, Monga M, Blanco JD. Ineffectiveness of latex condoms in preventing contamination of the transvaginal ultrasound transducer head. Southern Med J 1997;90:206-208.
- Milki AA, Fisch JD. Vaginal ultrasound probe cover leakage: implications for patient care. Fertil Steril 1998;69(3):409-11.
- Amis S, Ruddy M, Kibbler CC, Economides DL, MacLean AB. Assessment of condoms as probe covers for transvaginal sonography. J Clin Ultrasound 2000; 28: 295–8.
- Masood J, Voulgaris S, Awogu O, Younis C, Ball AJ, Carr TW. Condom perforation during transrectal ultrasound guided (TRUS) prostate biopsies: a potential infection risk. Int Urol Nephrol 2007; 39:1121–1124.
- Kac G, Podglajen I, Si-Mohamed A, Rodi A, Grataloup C, Meyer G. Evaluation of ultraviolet C for disinfection of endocavitary ultrasound transducers persistently contaminated despite probe covers. Infect Control Hosp Epidemiol. Feb. 2010, 31(2):165-70.
- Basseal JM, Westerway SC, Hyett JA. Analysis of the integrity of ultrasound probe covers used for transvaginal examinations. Infect Dis Health. 2020;25(2):77-81
- Alfa MJ. Intra-cavitary ultrasound probes: Cleaning and high-level disinfection are necessary for both the probe head and handle to reduce the risk of infection transmission. Infect Control Hosp Epidemiol 2015;36:585–586.
- Ngu A, McNally G, Patel D, Gorgis V, Leroy S, Burdach J. Reducing Transmission Risk Through High-Level Disinfection of Transvaginal Ultrasound Transducer Handles. Infect Control Hosp Epidemiol 2015;36:581-84.
- L. Gillespie, Kathryn E. Arnold, Judith Noble-Wang, Bette Jensen, Matthew Arduino, Jeffrey Hageman, Arjun Srinivasan. Outbreak of Pseudomonas aeruginosa Infections After Transrectal Ultrasound-Guided Prostate Biopsy. Urology, Volume 69, Issue 5, 2007, Pages 912-914.
- Abramowicz JS, Evans DH, Fowlkes JB, Marsal K, Terhaar G, (on behalf of the WFUMB safety committee). Guidelines for cleaning transvaginal ultrasound transducers between patients. Ultrasound in Med. & Biol. 43; 5:1076–1079, 2017.
- Carrico RM, Furmanek S, English C. Ultrasound probe use and reprocessing: Results from a national survey among U.S. infection preventionists. Am J Infect Control 2018;46:913-20.
- Ref. ECRI - Evaluations & Guidance. https://www.ecri.org/about/
- Mercy Health System (MHS) USA - https://www.cpsbc.ca/files/pdf/Steps-Cleaning-Disinfecting-Ultrasound-Probes.pdf How to Safely Store Your Ultrasound Probes - CIVCO Medical Solutions. https://www.civco.com/blog/safely-store-ultrasound-probes/
Vedlegg
- Kjemisk desinfeksjon https://infeksjonskontroll.no/forebygging/6883
- Klassifisering av ultralydprober – flytskjema i kategoriene kritiske, semikritiske og ikke kritiske prosedyrer.
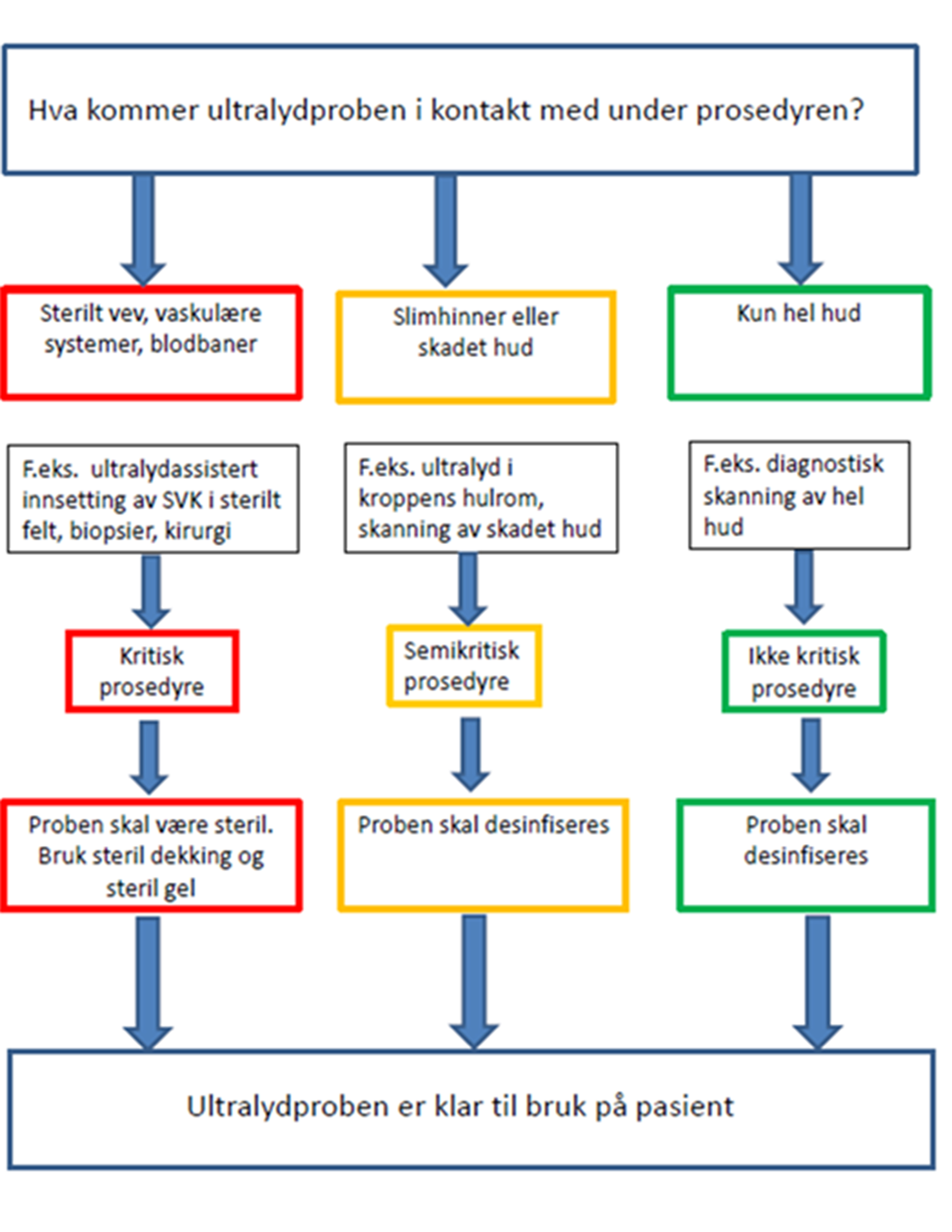
Modifisert etter: Ruth M. Carrico PhD et al. "Ultrasound probe use and reprocessing: Results from a national survey among U.S. infection preventionists. AJIC, 46(2018)913-20.